Los conocimientos científicos han ido evolucionando junto con la historia de la humanidad a través de los siglos. En la mayor parte de esta historia, han estado ligados a las creencias religiosas, desde los egipcios hasta el cristianismo. Y en muchos momentos la comunidad científica creía haber llegado al máximo conocimiento posible.
Pero siempre venía alguien a desmontar esa creencia con una nueva teoría.
Copernico, Galileo, Newton, Maxwell, Einstein, y muchos otros retaron la capacidad intelectual del hombre para ir un paso más lejos en el conocimiento de la Naturaleza. Y como el conocimiento se iba diversificando empezamos a dividirlo en áreas.
Una de esas áreas del conocimiento es la Termodinámica. Esta es la que se encarga del estudio de las transmisiones de energía. En especial las que están relacionadas con el calor.
El calor, el fuego, fue lo que hizo que el hombre se distinguiera como especie, por lo que es un tema muy serio. Y el estudio de las transmisiones de energía mucho más importante de lo que parecía en un principio.
Al sistema Geocéntrico le dio la vuelta el Heliocéntrico. Y a este, con la Ley de la Gravedad, Newton lo dejó perdido en el Espacio infinito metido en una Galaxia. Y con muchos científicos dando pinceladas a lo que pensaban que era todo lo que la Física tenía que ofrecer. Pero siempre había algo que no encajaba del todo. Lo más peleagudo era, (¡que raro!,) describir el calor o energía que irradiaba un cuerpo negro. Volvemos a la Termodinámica y al fuego-calor-energía que nos hace salir de la cueva.
¿Y que nos encontramos esta vez? Pues a Plank, Einstein y compañía volviendo a descolocar todo otra vez con la Física Cuántica. Y todo porque la Termodinámica no quería encajar bien con las Leyes de Maxwell.
¿Y por qué las Leyes de Maxwell y todos los demás principios y teoremas tienen que llevarse bien con la Termodinámica? Si hemos visto que al final toda la Física que conocemos es como una cebolla y siempre termina por aparecer una capa superior. ¿Por qué razón parece que la Termodinámica tiene siempre que encajar en todas partes?
Para responder a esas preguntas primero hay que entender la esencia de la Termodinámica. Como ya hemos dicho es una rama enfocada al estudio de la transferencias de energía. Y como su nombre indica «termo», del calor o de su ausencia. Pues al final muchos de los flujos energéticos que ocurren en la Naturaleza los percibimos en forma de calor. El mejor ejemplo, el Sol.

¿Y como se estudia todo esto? Analizando el comportamiento de las partículas más pequeñas. Como se «excitan» o se «frenan» con el aumento o disminución de la energía que les llega. Viendo como se distribuyen en los contenedores que los acogen o en el espacio. Como se relacionan entre los diferentes tipos de partículas. Y un largo etcétera.
Después de analizar todo esto, los especialistas llegaron a la conclusión de que todos los comportamientos se regían por una serie de normas. Y las redujeron a los tres principios o leyes de la Termodinámica. O más bien cuatro.
Primero fue Carnot, alma mater de esta especialidad, quien en 1824 simplificó todo en un par de principios. Luego llegaron Clausius y Thomson, más conocido como Lord Kelvin. En 1860 decidieron que Carnot estaba muy en lo cierto, pero que había que definirlo mejor y más matemáticamente. Y luego Nerst redondeó las Leyes de la Termodinámica a principios del siglo XX.
Y como había algún resquicio, Guggenheim y Fowler, completaron la terna anterior con el que, aunque no está reconocido en todos los ámbitos, se considera el principio o ley cero.
Por lo tanto las Leyes de la Termodinámica son:
0: «Ley del Equilibrio Térmico»
Si dos sistemas están en equilibrio térmico independientemente con un tercer sistema, deben estar en equilibrio térmico entre sí .
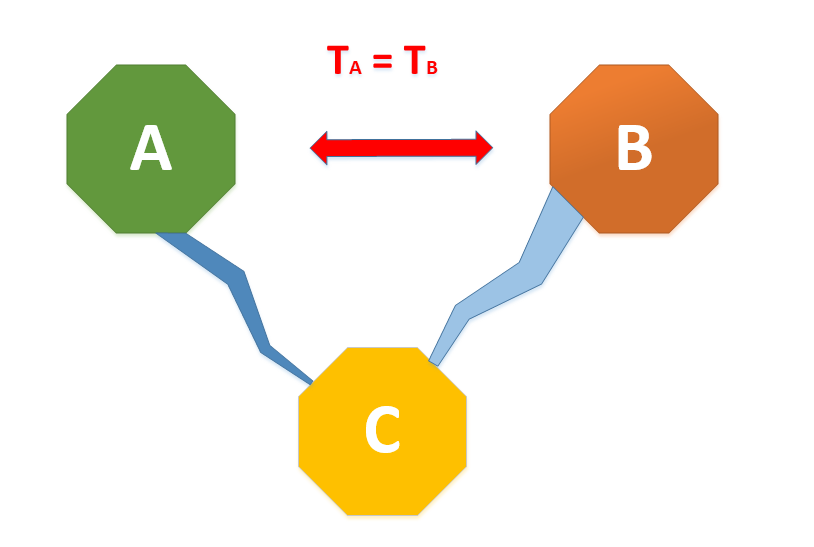
Para entender este concepto hay que definir dos términos. Sistema y equilibrio térmico. Sistema es fácil. Un sistema es el objeto de estudio. Un conjunto de partículas en alguno de los estados de la materia caracterizado por unas condiciones particulares de energía, volumen, etc. El equilibrio térmico es más complicado de entender pero es una forma de decir que ya no se produce flujo de energía entre los dos sistemas.
Cuando, por ejemplo, sacamos un refresco de la nevera y lo dejamos al aire, el líquido se va calentando hasta que se encuentra a la misma temperatura que la del aire a su alrededor. En este proceso, las partículas de la bebida estaban más «dormidas» y las del aire, que están más activas, las han ido despertando hasta que todas llegan a estar igual de movidas.
Este ejemplo nos permite entender la temperatura, pues esta es en realidad una medida de la energía interna de las partículas de un sistema. Cuanto más excitadas están las partículas más caliente está el sistema. Y una partícula que está excitada, hace que se excite la que está al lado. De esta forma, cuando una partícula ralentizada del líquido entra en interacción con una más activa del aire, esta se activa. Y activa a las que tiene al lado. Hasta que todas vibran igual. A la misma temperatura.
Cuando este intercambio se produce entre un sistema pequeño y otro muy grande, el grande no se ve alterado. Se denomina foco térmico. Por contra, si son dos sistemas pequeños, uno se calentará mientras que el otro, al perder energía para calentar el primero, se enfriará.
Por lo que si volvemos al enunciado de esta precuela de las leyes de la Termodinámica, vemos como dos sistemas que no se tocan pueden llegar a estar a la misma temperatura si entre ellos hay otro sistema que los conecte. Los tres terminan teniendo la misma energía en forma de calor en sus partículas. Llegan al equilibrio térmico.
1: «Ley de la Conservación de la energía»

Como hemos visto antes, un sistema que entra en contacto con otro cambia. Por lo que se está produciendo un intercambio de energía. En el caso anterior es en forma de calor. Pues la energía fluye del sistema más caliente al sistema más frío. Por lo tanto, si un sistema no está en contacto con otro, no existe flujo de energía. Y al no haber flujo de energía, el sistema se mantiene en equilibrio.
Esto es lo que se formula en este primer enunciado de las Leyes de la Termodinámica. Que un sistema aislado conserva su energía. Ni la pierde ni la gana. Por esto decimos que la energía ni se crea ni se destruye, se transforma. Una parte en trabajo y otra en calor. Que es otra forma de llamar a las energías mecánicas y térmicas.
ΔU = Q – W.
Esto que parece tan obvio es muy importante, pues es la razón por la que no existan lo que denominamos Móviles perpetuos. Un sistema no puede encontrarse en movimiento si está aislado y no puede producirse un flujo de energía de cualquier índole. Y esto en la práctica significa que no podemos obtener infinita energía de un sistema, pues se perderá un porcentaje de esta por interacción con otros sistemas. Como por ejemplo el efecto Joule que describe las pérdidas por calor en electrónica al calentarse los materiales.
2: «Ley de la Entropía»

Esta ley tiene dos enunciados equivalentes. El primero formulado por Clausius y el segundo por Kelvin con la ayuda de Plank.
Clausius: No es posible un proceso cuyo único resultado sea la transferencia de calor de un cuerpo de menor temperatura a otro de mayor temperatura.
Kelvin-Planck: No es posible un proceso cuyo único resultado sea la absorción de calor procedente de un foco y la conversión de este calor en trabajo.
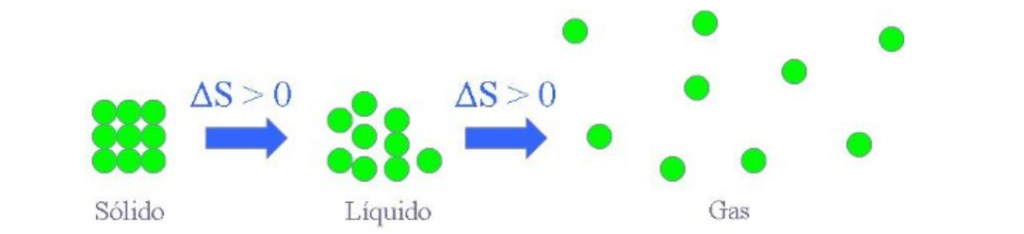
Así enunciado no parece tener mucho sentido. Pero lo que están definiendo estos enunciados es la Entropía, S. Este nuevo térmico es un intento de definir la forma que tienen las partículas de un gas de ordenarse en un medio. Se define como la cantidad de desorden de un sistema. Es inversamente proporcional a la temperatura. De forma que el estado de máximo orden se produce cerca del cero absoluto de temperaturas.
ΔS = ΔQ/T.
Esta es quizás la más importante de las Leyes de la Termodinámica. Pues es la que nos indica la evolución de cualquier sistema físico. Es la razón por la que se producen cosas como las transiciones de fase, o la explosión de las estrellas.
3: En el cero absoluto
La tercera de las Leyes de la Termodinámica es una suposición. La fórmula de la Entropía hace que en el cero absoluto, 0ºK, el incremento sea nulo. Por lo que el límite inferior de la integral es constante.
Esto quiere decir que en el cero absoluto las partículas de los sistemas, además de quedarse congeladas por la falta de energía interna, adoptan su forma más ordenada.
Gracias a esta propiedad de la materia existen los superconductores. Y como podemos definirla como la multiplicidad de los estado cuánticos, es también una de las bases de los procesos cuánticos.
¿Y por que es la más inmutable?
Una vez comprendidos estos principios o leyes de la Termodinámica podemos ver que su veracidad no solo es aplicable a pequeños sistemas líquidos o gaseosos. Sino que son leyes intrínsecas de la materia. Lo mires por donde lo mires. Espacios cuánticos, multiuniversos, cuerdas, relatividad o gravedad están sujetos a los flujos de energías. Y la entropía es el fundamento de la evolución del Universo.
Toda la Física ha de ser coherente con estos principios. Y por eso, cuando encontramos una singularidad en la descripción de la Naturaleza, como en su día fue el cuerpo negro y en la actualidad los agujeros negros (relaciona la entropía con el área de estos), las teorías que no son capaces de coexistir con las Leyes de la Termodinámica, son rápidamente descartadas.
Referencias:
- Física. Tipler Mosca.
- Física. M. Alonso y E. J. Finn.
- Introducción a la Termodinámica. C. Fernandez Pineda y S. Velasco Maillo.
- https://concepto.de/leyes-de-la-termodinamica/



Pingback: Cuerpo negro y catástrofe ultravioleta. - Fisicotrónica
Pingback: Física ¿qué? - Fisicotrónica
Pingback: Max Planck - Fisicotrónica
Pingback: Granada domina el tiempo. - Fisicotrónica
Pingback: Frontera Bekenstein. - Fisicotrónica
Pingback: Motor cuántico de tamaño atómico. - Fisicotrónica